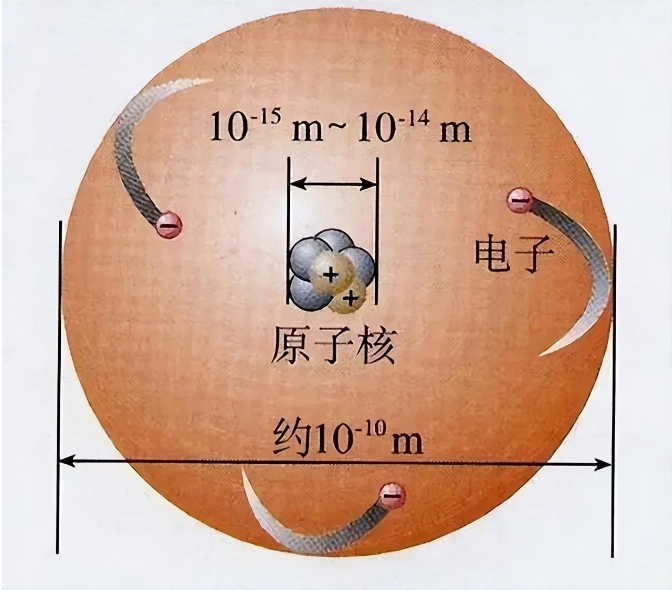
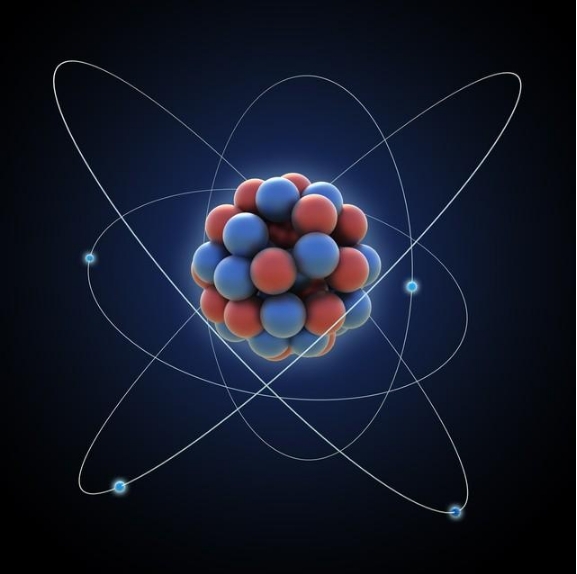
在物质世界中,无论我们观察到的是宏伟的山川、微小的细胞,还是肉眼不可见的原子,它们皆源自于一种统一的构建单元——原子。
这些原子,尽管本质上是由相同的基本成分构成,却展现出了惊人的多样性。这种多样性不仅体现在物质的形态和颜色上,更体现在它们的化学性质和反应行为上。黄金和汞,两种元素的原子,仅仅相差一个电子,却拥有截然不同的性质。黄金是珍贵的金属,化学性质稳定,而汞却是有毒的液体。如此微小的差异,却造成了物质性质的天壤之别,这背后的原因,正是泡利的不相容原理所要揭示的秘密。
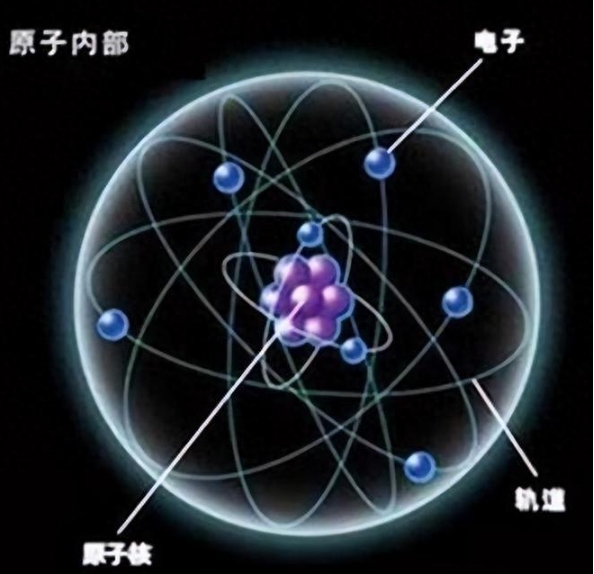
在探索原子结构的历程中,物理学家尼尔斯·波尔提出了一种革命性的模型。他认为,原子不像实心球体,而是由位于中心的原子核和在外层绕核运动的电子组成。电子并非随意分布在原子周围,而是按照能量高低分布在不同的壳层中,这就像地球围绕太阳的多个轨道一样。然而,波尔的模型并未完全解决原子稳定性和多样性的问题。
这时,泡利提出了重要的补充。他接受了波尔的量子跃迁模式,即电子可以瞬间从一个壳层跃迁到另一个壳层,并进一步发展了这一概念。
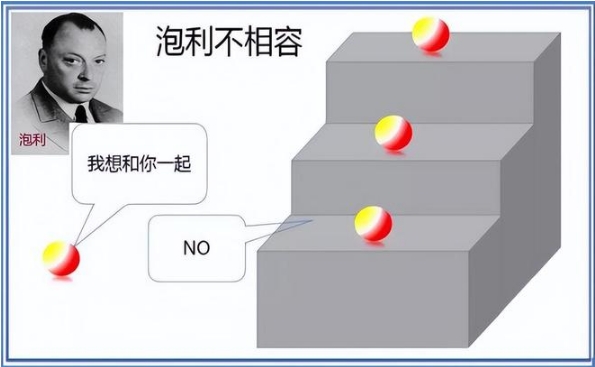
泡利引入了一条新的量子法则——不相容原理。这一原理指出,每个电子壳层最多能容纳一定数量的电子,新加入的电子会优先填充未满的壳层。当最高壳层满员时,原子会为了容纳更多的电子而形成新的壳层,从而导致原子结构和性质的根本变化。这一理论不仅解释了原子为何会有不同的化学性质,也为元素周期表的排列提供了理论基础。
泡利的不相容原理是理解原子多样性的关键。这一原理规定,每个电子层或壳层最多只能容纳一定数量的电子,这个数量是由量子力学的规则所决定的。

当一个原子尝试吸收一个新电子时,它会首先检查最高层是否有空位。如果有空位,新电子将填充这个空位;如果没有,原子就会形成一个新的电子层来容纳这个电子。
这个简单的规则导致了原子性质的丰富多样性。因为每个电子层的填充都会导致原子的能量状态发生变化,所以即使是原子序数相邻的元素,也会因为电子层结构的不同而具有截然不同的性质。

例如,钠和镁虽然只相差一个电子,但它们的化学性质却大相径庭。钠的最外层只有一个电子,容易失去,而镁的最外层有两个电子,相对较稳定。这种电子层结构的变化,不仅影响了原子的化学反应性,也决定了元素在周期表中的位置。
不相容原理不仅是物理学的一大里程碑,更是生物学和化学基础的理论支柱。在生物体内,各种化学反应不断发生,这些反应的进行与否,以及如何进行,都与原子的电子结构密切相关。生物分子的多样性,如蛋白质、核酸等,归根结底是由原子的电子排布决定的。因为不同的电子排布会导致不同的化学性质,所以生物体内的化学反应才会有选择性地进行。
同样,在化学领域,元素周期表的排列正是基于不相容原理。元素的周期性规律不仅表现在它们的原子半径、电离能等物理性质上,更体现在它们的化学性质上。

不相容原理解释了为什么元素会按照特定的顺序排列,以及为什么同族元素会有相似的化学性质。因此,不相容原理不仅深化了我们对物质微观结构的理解,也为宏观化学现象提供了理论基础。
泡利的不相容原理对经典物理学构成了巨大的挑战。在经典物理学的框架下,物质的运动和行为是可以精确预测的,但量子力学,尤其是不相容原理,却引入了不确定性。这一原理表明,我们无法同时准确知道一个电子的确切位置和动量,这种不确定性是微观粒子世界的固有属性。
量子力学的发展,特别是泡利的不相容原理,标志着物理学进入了一个新的时代。它不仅解释了原子和分子行为的奇特性,也为后续的量子电动力学、量子场论等理论的发展奠定了基础。这些理论进一步深化了我们对自然界的认识,推动了现代技术的飞速进步,从半导体物理到量子计算,无不体现着量子力学的深远影响。